El Consejo de Ministros ha aprobado este martes el Real Decreto por el que se modifica el RD 1662/2000, de 29 de septiembre, sobre productos sanitarios para diagnóstico invitro, con objeto de regular la venta al público y la publicidad de los productos de autodiagnóstico de la Covid-19.
La situación de crisis sanitaria ocasionada por el virus «hace necesario aumentar la capacidad diagnóstica del Sistema Nacional de Salud, con objeto de identificar de forma rápida sospechas de casos positivos de SARS-CoV-2, para tomar las medidas adecuadas y así controlar eficazmente la progresión de la pandemia y al mismo tiempo atender a los afectados por la misma y ayudar a su recuperación2, ha informado desde Sanidad.
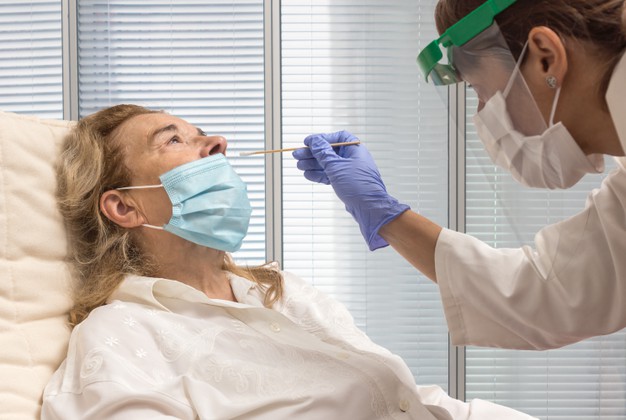
La disponibilidad de pruebas de autodiagnóstico de la Covid-19, permitirá a la población general la realización de las pruebas sin la intervención de un profesional sanitario, lo que, por un lado, reducirá en cierta medida la presión asistencial de los centros sanitarios, y por otro, permitirá la identificación rápida de sospechas de casos positivos.
En este sentido, la utilización de pruebas rápidas de antígeno se ha considerado una herramienta útil para lograr el objetivo señalado de ampliar la capacidad diagnóstica.
Actualmente, existen en el mercado pruebas rápidas de antígeno de uso profesional que ya se están utilizando. Asimismo, han comenzado a comercializarse en Europa pruebas rápidas de antígeno de autodiagnóstico.
El citado real decreto establece, con carácter general, la exigencia de prescripción para la venta al público de los productos de autodiagnóstico con la excepción de ciertos tipos (diagnóstico del embarazo y de la fertilidad, autodiagnóstico de la glucemia y detección del VIH), entre los que no se incluían hasta la fecha los productos para autodiagnóstico de la Covid-19.